Medizinprodukte
Klinische Bewertung (CER) / Klinischer Bewertungsplan (CEP)
Hersteller von Medizinprodukten sind verpflichtet, die Leistung und Sicherheit ihrer Produkte zu prüfen und den klinischen Nutzen zu belegen. Hierzu wird eine klinische Bewertung erstellt, die als klinischer Bewertungsbericht (Clinical Evaluation Report, CER) dokumentiert und kontinuierlich auf dem neuesten Stand gehalten wird. Mit der Anwendbarkeit der Verordnung (EU) 2017/745 (Medical Device Regulation, MDR) seit dem 26. Mai 2021 sind die Anforderungen an Medizinprodukte deutlich gestiegen und stellen Hersteller, vor allem von bereits vermarkteten Medizinprodukten, nicht selten vor neue bzw. besondere Herausforderungen.
Die klinische Bewertung umfasst eine Aufbereitung und Auswertung klinischer Daten aus der wissenschaftlichen Fachliteratur sowie Hersteller-eigener Produktdaten zur Sicherheit und Leistung des Medizinproduktes. Die anzuwendenden Verfahren für die klinische Bewertung werden in der Medizinprodukteverordnung (MDR) und in den von der Koordinierungsgruppe Medizinprodukte (MDCG) erarbeiteten Leitlinien und der Leitlinie MEDDEV 2.7/1 rev. 4spezifiziert. Abhängig von der Klasse des Medizinproduktes setzt sich die klinische Bewertung aus einer Betrachtung der Studien zu dem betreffenden Medizinprodukt selbst, Studien zu gleichwertigen Medizinprodukten (Äquivalenzprodukten), Literaturdaten zum medizinischen Hintergrund und den zugrundeliegenden Behandlungsstandards (State of the Art) sowie anderen sicherheitsrelevanten Daten (z.B. aus der Überwachung nach dem Inverkehrbringen des Medizinproduktes oder von den Webseiten und Datenbanken zuständiger Behörden) zusammen. Bestandsprodukte benötigen hier unter Umständen besondere Aufmerksamkeit. Mit Bedacht durchgeführt, kann hier eine Verzahnung der klinischen Daten aus der wissenschaftlichen Literatur mit vorhandenen Daten aus der Marktbeobachtung zu Leistung und Sicherheit erfolgen, gegebenenfalls unterstützt durch vorhandene oder neu erhobene Daten aus In-vitro- oder In-vivo-Studien oder Anwendungsbeobachtungen (AWB).
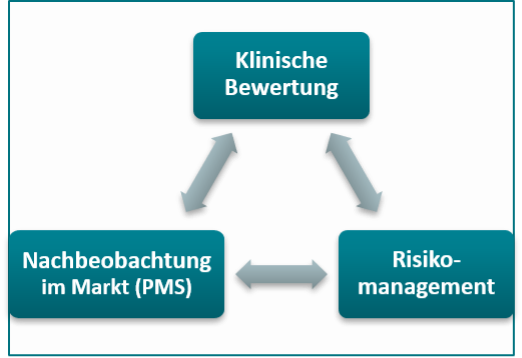
Im Laufe des Lebenszyklus eines Medizinproduktes ist die klinische Bewertung kontinuierlich zu aktualisieren. Eine enge Verknüpfung mit der Nachbeobachtung des Medizinproduktes im Markt sowie des aktuellen Risikomanagements ist hier essentiell.
Der klinische Bewertungsplan (Clinical Evaluation Plan, CEP) ist ein detaillierter Arbeitsplan für die Durchführung des klinischen Bewertungsverfahrens und sollte unter anderem die für das Medizinprodukt relevanten Sicherheits- und Leistungsanforderungen (General Safety and Performance Requirements, GSPRs) definieren. Weiterhin sind im CEP der Anwendungsbereich, die Methodik sowie der systematische Ansatz und die Strategie für das Vorgehen bei der klinischen Bewertung beschrieben, die im CER dokumentiert werden sollen.
Die Dr. Ebeling & Assoc. GmbH kann auf spezielles Fachwissen und Erfahrungswerte im Hinblick auf Medizinprodukte zurückgreifen und unterstützt Sie gerne umfassend in allen Punkten, die bezüglich einer erfolgreichen Umsetzung der aktuellen Regelungen für Ihre Medizinprodukte notwendig sind.