Medical and Regulatory Affairs
Life Cycle Management
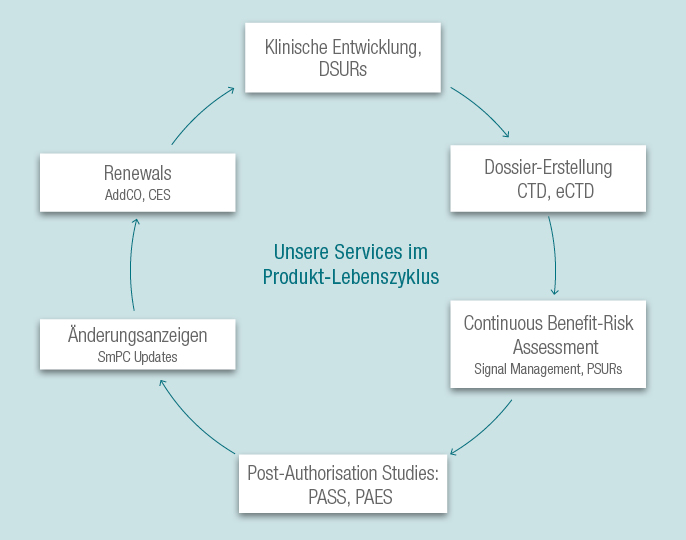
Wir bieten Ihnen Beratung und Unterstützung während des gesamten Produktlebenszyklus: während der klinischen Entwicklung und in der Vermarktungsphase.
Unser Konzept
Wir unterstützen Sie gerne bei der Erstellung von Zulassungsanträgen in Europa, den USA und anderen Regionen und haben Erfahrung mit verschiedenen Zulassungsarten (nationales Verfahren, zentralisiertes Verfahren, Verfahren der gegenseitigen Anerkennung und dezentrales Verfahren). Wir bieten Ihnen strategische Beratung bei der Auswahl des für Sie adäquaten Zulassungsverfahrens.
Nach der Einreichung des Dossiers bieten wir Ihnen Dienstleistungen über den gesamten Produktlebenszyklus. So erstellen wir für Verlängerungen der Zulassung (Renewals) die notwendigen Dokumente, wie z.B. das Addendum to the Clinical Overview (AddCO) und das Clinical Expert Statement (CES). Neue Erkenntnisse zum Nutzen-Risiko-Profil Ihrer Produkte, die während des Signal-Managements und der kontinuierlichen Nutzen-Risiko-Bewertung gewonnen wurden, werden in diesen Dokumenten evaluiert.
Notwendige Änderungsanzeigen, z.B. zur Aktualisierung der SmPC, werden durch uns begleitet. Außerdem unterstützen wir Sie bei der Planung von Post-Authorisation-Studien (PASS, PAES) zur Charakterisierung fehlender Daten bezüglich der Sicherheit oder Wirksamkeit.
Mit uns bleiben Sie auf dem neuesten Stand der Sicherheitsanforderungen für vermarktete Produkte.